Autores
Dra. Ana Marta López Mantecón
Especialista de 1er Grado en Reumatología.
Especialista de 1er Grado en Medicina General Integral
Dr. Andrés Pérez Ruiz
Especialista de 2do Grado en Fisiología Normal y Patológica
Profesor Auxiliar.
Resumen
Se realiza una revisión bibliográfica sobre la sensibilidad de las plaquetas a la acción de los antinflamatorios no esteroideos (AINEs), con énfasis en el mecanismo de acción de estas sustancias sobre partículas o elementos formes de la sangre.
Las plaquetas están involucradas de manera protagónica en una de las funciones vitales de la sangre, la “hemostasia” ya que las mismas aparecen involucradas en cada uno de los eventos que determinan la denominada hemostasia natural; se destaca el notable papel que en cada uno desempeñan las plaquetas.
Hacemos una clasificación de los AINEs donde acotamos prácticamente a todos los conocidos y agregamos los Coxib por constituir una generación que aunque no resulta ser tan gastrolesivo, ha generado toda una polémica sobre sus efectos adversos cardiovasculares, se alude al mecanismo de acción de los AINEs clásicos inhibiendo a la COX-1 y COX-2 y a los inhibidores selectivos de COX-2, así como en que tejidos y bajo que condiciones se expresan las isoformas expuestas de las ciclooxigenasas.
El presente artículo tiene el propósito de acercar al profesional de la salud involucrado con la prescripción de estas sustancias sobre su acción en el proceso de inactivación principalmente de enzimas presentes en las plaquetas y la participación de ellas en importantes acontecimientos de la hemostasia natural.
Introducción
Las plaquetas juegan un papel fundamental en cada uno de los acontecimientos que determinan la Hemostasia natural.
La hemostasia normal es el resultado de una serie de procesos perfectamente regulados que cumplen dos funciones importantes:(1)
1) Mantener la sangre en estado líquido y sin coágulos dentro de los vasos sanguíneos normales.
2) Estar preparado para formar rápidamente un tapón hemostático localizado en el punto de lesión vascular.
El proceso patológico opuesto a la hemostasia es la trombosis, que puede considerarse como el resultado de una activación inadecuada de los procesos hemostáticos normales, como la formación de un coágulo de sangre (trombo) en los vasos no lesionados, o la oclusión trombótica de un vaso después de una lesión de escasa importancia.(2,3)
Tanto la hemostasia como la trombosis dependen de tres factores generales:
1) La pared vascular
2) Las plaquetas
3) Cascada de la coagulación
Los fenómenos de la hemostasia ocurren sucesivamente en el lugar de una lesión vascular y se muestran en los siguientes esquemas que a continuación se representan:
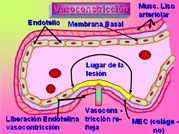

Esquema 1
Después de la lesión inicial, se produce una vasoconstricción arteriolar de breve duración, que en gran parte se atribuye a mecanismos neurógenos reflejos y que se acentúa con la secreción local de ciertos factores, como la endotelina, un potente vasoconstrictor derivado del endotelio y el Tromboxano A2 (TxA2) con propiedades vasoconstrictoras locales derivado de las plaquetas que se reúnen en la zona producto del enlentecimiento del flujo sanguíneo debido a la vasoconstricción (4) (Esquema 1).
Pero su efecto es pasajero, y la hemorragia reaparecería si no fuera por la activación de las plaquetas y de los sistemas de la coagulación.
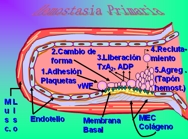

Esquema 2
La lesión del endotelio deja al descubierto la matriz extracelular subendotelial (MEC), de intenso poder trombógeno, que permite a las plaquetas adherirse y activarse, es decir, sufrir un cambio de forma y vaciar sus granulaciones secretorias. En pocos minutos, los productos secretados atraen a otras plaquetas y se forma el tapón hemostático; éste es el proceso de la hemostasia primaria.
Las plaquetas se adhieren a la MEC expuesta mediante el factor de von Willebrand (vWF), y se activan, cambiando de forma y liberando sus granulaciones; el difosfato de adenosina (ADP) y el TxA2 liberados producen una nueva agregación plaquetaria que forma el tapón hemostático primario, el cual comentaremos con más detalle en el desarrollo(5) (Esquema 2).
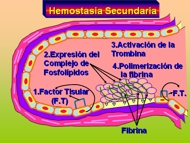

Esquema 3
El factor tisular, que es un factor procoagulante unido a la membrana y sintetizado por el endotelio, también queda al descubierto en el sitio de la lesión. Este factor actúa junto a los factores secretados por las plaquetas para activar la cascada de la coagulación, y culmina con la activación de la trombina. La trombina, a su vez, convierte al fibrinógeno disuelto en la sangre en fibrina insoluble, que acaba depositándose localmente. La trombina también produce un nuevo reclutamiento de plaquetas y la liberación de sus granulaciones. Esta serie de fenómenos (la hemostasia secundaria) dura más tiempo que la formación del tapón plaquetario.
La activación local de la cascada de la coagulación (donde participan el factor tisular y los fosfolípidos plaquetarios) da lugar a la polimerización de la fibrina, que aglutina o <> a las plaquetas en un tapón hemostático secundario definitivo (6) (Esquema 3).
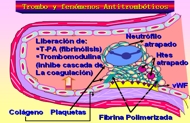

Esquema 4
La fibrina polimerizada y los agregados de plaquetas forman un sólido tapón permanente que impide cualquier nueva hemorragia. En esta fase, se ponen en marcha los mecanismos de contrarregulación (p. ej., el activador del plasminógeno tisular (t-PA), para que el tapón hemostático quede circunscrito al sitio de la lesión.
Los mecanismos de contrarregulación, como la liberación del activador del plasminógeno tisular (t-PA) de acción fibrinolítica) y de trombomodulina (que interfiere con la cascada de la coagulación), limitan el proceso hemostático al lugar de la lesión (7, 8) (Esquema 8).
Si analizamos con precisión cada uno de los eventos de la hemostasia natural antes comentados, observaremos inmediatamente que las plaquetas juegan un rol determinante en cada uno de ellos, de manera que toda sustancia que inhiba la participación de las plaquetas estará comprometiendo el mecanismo de la hemostasia natural.
Este trabajo tiene el propósito de analizar la participación de los AINEs y su sensibilidad en la inactivación de las plaquetas, demostrando que se comprometen tanto la denominada hemostasia primaria, como la formación del tapón hemostático definitivo, es decir, la hemostasia secundaria.
Desarrollo
Los AINEs, clasificación
Los AINEs incluyen muy diversos compuestos que aunque casi nunca tienen relación química alguna, si comparten actividades terapéuticas y efectos colaterales
En este vasto grupo se incluyen los fármacos antiinflamatorios, analgésicos, antipiréticos y en la actualidad dentro de sus acciones farmacológicas debe considerarse su efecto antiagregante plaquetario. (9)
Principales grupos químicos de AINEs
a) Salicilatos:
ASA (ácido acetilsalicílico)
Diflunisal
b) Derivados pirazolónicos:
Aminofenazona (dipirona o metamizol)
Fenilbutazona
Azaprofazona
c) Derivados del para-aminofenol:
Acetaminofen (paracetamol)
d) Derivados del ácido acético:
Indometacina
Sulindaco
Glucametacina
e) Derivados carboxílicos y pirrolpirrólicos:
Etodolaco
Ketorolaco
f) Derivados del ácido fenilacélico:
Diclofenaco
Aclofenaco
Tolmetina
Fenclofenaco
g) Derivados del ácido n-acetilantranílico:
Ácido mefenámico
Niflumico
Meclofenamico
Clonixinato de lisina
h) Derivados del ácido propiónico:
Ibuprofeno, Naproxeno, Ketoprofeno
Flurbiprofeno, Fenoprofeno, Oxaprozina
i) Derivados enólicos
Piroxicam
Meloxicam
Tenoxicam
j) Nimesulida, sulfonanilida
k) Grupo naftilalcanonas:
Nabumetona
Antiinflamatorios inhibidores de la COX-2 (coxib):
Celecoxib
Rofecoxib
Mecanismo de acción de los Antiinflamatorios no Esteroideos
Cuando las células son activadas por diversos estímulos, los lípidos de sus membranas se remodelan rápidamente para generar mediadores lipídicos biológicamente activos que actúan como señales intra o extracelulares. Los productos derivados del Ácido Araquidónico (AA) ejercen su acción sobre diversos productos biológicos, como la inflamación y la hemostasia. Estos productos se forman muy rápidamente, actúan localmente y después se degradan espontáneamente o son destruidos enzimáticamente.
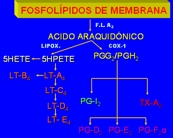

Esquema 5
El AA es un ácido graso poliinsaturado de 20 átomos de carbono (ácido 5,8,11,14- eicosatetraenoico), que procede directamente de la dieta o de la conversión a partir del ácido linoleico. No existe en forma libre en el interior de la célula, pero normalmente está esterificado en los fofsfolípidos de membrana, especialmente en la posición del carbono 2 de la fosfatidilcolina, el fosfatidilinositol y la fosfatidil etanolamina. Se libera de los fosfolípidos de la membrana por la activación de las fosfolipasas celulares (p. ej., fosfolipasa A2) a través de estímulos mecánicos, químicos y físicos, o por acción de otros mediadores ( p. ej., C5a).
Los metabolitos del AA, también denominados eicosanoides, son sintetizados mediante dos clases principales de enzimas: ciclooxigenasas (prostaglandina y tromboxanos) y lipoxigenasas (leucotrienos y lipoxinas). Los puntos intracelulares sobre los que actúan las enzimas para dar lugar a la producción de mediadores eicosanoides son las regiones especializadas, conocidas como cuerpos lipídicos, que contienen todas las principales enzimas generadoras de eicosanoides y que se forman rápidamente en respuesta frente agentes como el FAP. La compartimentalización de la formación de eicosanoides en los cuerpos lipídicos proporciona una reserva de araquidonato que podría ser utilizada para producir mediadores sin afectar a otras membranas celulares (10) (Esquema 5.
La vía de la ciclooxigenasa, mediada por dos enzimas diferentes (COX-1 y COX-2), da lugar a la generación de las prostaglandinas. Las prostaglandinas se clasifican en diversas series según sus características estructurales y se codifican por una letra (PGD, PGE, PGF, PGG y PGH) y por un subíndice númerico (p. ej., 1 y 2) que indica el número de dobles enlaces del compuesto. Las prostaglandinas más importantes en la inflamación son PGE2, PGD2 PGF2α, PGI2 (prostaciclina) y TxA2 (tromboxano), todas las cuales proceden de la acción de una enzima específica. Algunas de estas enzimas muestran una distribución tisular restringida.
Por ejemplo las plaquetas contienen la enzima tromboxano sintetasa y, por tanto, el TxA2 es el producto principal en estas células. El TxA2 es un potente agregante plaquetario y vasoconstrictor, es inestable y se convierte rápidamente en su forma inactiva, TxB2. El endotelio vascular carece de tromboxano sintetasa, pero posee prostaciclina sinstetasa, que da lugar a la formación de prostaciclina (PGI2) y de su producto final estable, PGF1α. La PG-I2 es un vasodilatador potente, inhibidor de la agregación plaquetaria y, además, potencia de manera intensa los efectos quimiotactico y de incremento de la permeabilidad de otros mediadores. El desequilibrio tromboxano-prostaciclina ha sido implicado como un acontecimiento inicial en la formación de trombos en los vasos sanguíneos coronarios y cerebrales. (11)
La primera enzima en la vía sintética de prostaglandina es la prostaglandina de endoperoxido sintetasa o ciclooxigenasa de ácidos grasos; esa enzima transforma al AA en productos intermediarios inestables, PGG2 y PGH2. La COX-1 es una isoforma constitutiva que aparece en vasos sanguíneos, estómago y riñones, en tanto que la COX-2 se presenta en situaciones de inflamación por citocinas y mediadores inflamatorios. Los antinflamatorios no esteroideos inhiben a la enzima ciclooxigenasa y la producción de prostaglandina, pero no suprimen las vías de la lipooxigenas ni la formación de leucotrienos.
La aspirina en forma covalente modifica las dos variantes de ciclooxigenasas (1 y 2), y así logra inhibición irreversible de la actividad de estas enzimas, ello constituye un acción importante y peculiar de la aspirina, dado que la duración de los efectos de este fármaco dependen de la velocidad de recambio de ciclooxigenasa en diferentes tejidos “blanco”. En la estructura de COX-1, la aspirina acetila la serina 530, de modo que impide se ligue el ácido araquidónico al sitio activo de la enzima y de ese modo, la posibilidad de que esta última elabore prostaglandinas. En el caso de COX-2, la aspirina acetila una serie homóloga en posición 516. Las modificación covalente de COX-2 por parte de la aspirina también bloque la actividad de la ciclooxigenasa de dicha isoforma, pero una propiedad interesante de COX-2 no compartida por COX-1 es que COX-2 acetilada comienza a sintetizar 15-HETE.
Las plaquetas son especialmente sensibles a la inactivación irreversible de la ciclooxigenasa mediada por aspirina porque poseen escasa o nula habilidad para la biosíntesis de proteínas y, de ese modo, no regeneran a la enzima ciclooxigenasa. En términos prácticos, ello significa que una sola dosis del fármaco inhibirá la ciclooxigenasa plaquetaria durante toda la vida de la plaqueta (8 a 11 días); en seres humanos, basta una sola dosis de 40 mg de aspirina para producir dicho efecto. La inhibición de las plaquetas con una dosis tan pequeña depende del bloqueo presistémico de la ciclooxigenasa en la circulación porta antes de que la aspirina sea desacetilada en el hígado hasta dar salicilato. A diferencia de la aspirina, el ácido salicílico no posee habilidad acetiladora. Sin embargo a semejanza de la aspirina, disminuye la síntesis de prostaglandinas in vivo. (12, 13, 14)
La mayor parte de los AINEs que aparecen en la clasificación antes mencionadas son ácidos orgánicos y a diferencia del ácido acetil salicílico constituyen inhibidores
competitivos reversibles de la actividad de ciclooxigenas.
En la forma de ácidos orgánicos, dichos compuestos casi siempre se absorben adecuadamente después de ser ingeridos, luego se ligan ávidamente a las proteínas plasmáticas y se excretan por filtración glomerular o secreción tubular. A diferencia de la aspirina, cuya duración depende de la velocidad de síntesis de nueva ciclooxigenasa, la duración de acción de otros AINEs, que son inhibidores reversibles de dicha enzima, depende más bien de su eliminación farmacocinética desde el organismo. En términos generales, los antiinflamatorios de dicha categoría se dividen en dos grupos, es decir, los que tienen vida media breve (menos de seis horas) y larga (más de 10 horas). (15,16)
Los inhibidores de COX-2, conocidos como coxib son un nuevo tipo de fármacos antiinflamatorios capaces de inhibir selectivamente COX-2, sin inhibir COX-1, en todo su espectro terapéutico. Su eficacia antiinflamatoria y analgésica es similar a la de los AINEs clásicos (diclofenaco, ibuprofeno, naproxeno y otros), y carecen de los efectos adversos derivados de la inhibición de COX-1 (toxicidad gastrointestinal y alteración de la agregabilidad plaquetaria).
La isoforma COX-1 es responsable de la síntesis de tromboxano A2, activador de la agregación plaquetaria. Los coxib, en consecuencia, no tienen actividad antiagregante, por tanto, los coxib como confirmación de esta inhibición específica de COX-2, carecen del efecto cardioprotector que poseen la aspirina y, en mayor o menor medida, los AINEs clásicos, causa que se ha invocado sistemáticamente en los últimos años en los efectos adversos sobre el aparato cardiovascular. A través de un estudio publicado en JAMA, se conoció que la incidencia de infarto de miocardio era mayor en los pacientes tratados con coxib que en el grupo placebo; los autores proponen que la disminución de la síntesis de prostaciclina (PGI2) con capacidad antiagregante y vasodilatadora, secundaria a la inhibición de COX-2, sin inhibir el tromboxano A2 (agregante plaquetario), puede afectar el equilibrio entre prostaglandinas protrombóticas y antitrombóticas, aumentando la actividad protrombótica. A pesar de que incluso, los coxibs también podrían tener actividad antiaterogénica por el reconocido papel de la inflamación en el desarrollo de aterosclerosis, se ha demostrado que el uso de coxib esta directamente vinculado al aumento del daño cardiovascular. (17, 18, 19)
Inhibición del proceso de formación de agregados plaquetarios (hemostasia primaria), mediante la aspirina:
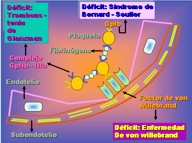

La adhesión de las plaquetas a la MEC está mediada en gran parte por interacciones con el vWF, que actúa de puente entre los receptores de la superficie plaquetaria (p. ej., la glucoproteína Ib) y el colágeno expuesto.
Aunque la adhesión a la MEC se produce también directamente, a través de los receptores de colágeno que poseen las plaquetas y de interacciones con la fibronectina, la interacción con vWF - GP-Ib es sumamente importante por que es la única vía conocida capaz de consolidar la adhesión inicial de las plaquetas destinada a oponerse a las poderosas fuerzas de cizalla que ejerce la corriente sanguínea. Por tanto, un déficit del vWF (enfermedad de von Willebrand) o de su receptor la GP-1b (síndrome de Bernard -Soulier) producen una adhesión defectuosa de las plaquetas y un trastorno hemorrágico (20) (Esquema 6).
La agregación plaquetaria es el paso siguiente a la adhesión y la secreción. Además del ADP, el TxA2 que es un producto vasoconstrictor de las plaquetas, estimula también la agregación plaquetaria.
El ADP y el TxA2 ponen en marcha una reacción autocatalítica, que conduce a la formación de un agregado creciente de plaquetas: el tapón hemostático primario. Esta agregación es reversible, pero al activar la cascada de la coagulación, se forma la trombina. La trombina se une al receptor superficial de las plaquetas y, junto con el ADP y el TxA2, produce más agregación. Esto va seguido de la retracción de las plaquetas, que acaban formando una masa irreversiblemente fundida de plaquetas (metamorfosis viscosa), que constituye el definitivo tapón hemostático secundario. Al mismo tiempo, en toda la extensión del tapón plaquetario, la trombina convierte al fibrinógeno en fibrina, formando prácticamente un consolidado con las plaquetas que allí se encuentran. Por tanto, la trombina es esencial para la formación de los trombos y, de hecho, es una importante sustancia contra la que se dirige el tratamiento antitrombótico.
El fibrinógeno es también un cofactor importante en la agregación plaquetaria; las plaquetas activadas por el ADP se unen al fibrinógeno, y éste a su vez a otras plaquetas mediante los receptores de (GP IIb -IIIa), formándose así grandes agregados de plaquetas. Los pacientes cuyas GP IIb – IIIa son deficientes de forma congénita (tromboastenia de Glanzmann) sufren trastornos hemorrágicos graves atribuibles a una agregación plaquetaria defectuosa. (1, 10)
El eicosanoide PG-I2 derivado del endotelio es una sustancia vasodilatadora que inhibe la agregación plaquetaria, mientras que el eicosanoide TxA2 derivado de las plaquetas es un potente vasoconstrictor que activa la agregación plaquetaria como comentábamos en anteriores apartados. El juego recíproco entre PG-I2 y el TxA2 constituye un mecanismo finamente equilibrado que sirve para regular la función plaquetaria del ser humano: en condiciones normales, este mecanismo impide la agregación plaquetaria intravascular, pero después de una lesión endotelial, favorece la formación de los tapones hemostáticos. La utilidad de la aspirina en los pacientes expuestos a una trombosis coronaria (la aspirina acetila e inactiva irreversiblemente a la ciclooxigenasa) se debe, en gran parte, a su capacidad para inhibir la síntesis del TxA2 .El óxido nítrico, igual que la PG-I2, actúa también como vasodilatador e inhibidor de la agregación plaquetaria. (21)
Los tapones hemostáticos contienen también hematíes y leucocitos; los leucocitos se adhieren a las plaquetas por la adhesión selectina –P, y al endotelio utilizando varios receptores de adhesión; contribuyen a la reacción inflamatoria que acompaña a la trombosis.
La trombina también estimula directamente la adhesión de los neutrófilos y monocitos y, por desdoblamiento del fibrinógeno, genera los productos de la fibrina, que poseen acción quimiotáctica.
Por otro lado las altas dosis y tratamientos prolongados con aspirina inhiben la síntesis de los factores de la coagulación vitamina K dependientes (II, VII, IX, X y PCa), llegando a producir cuadros hemorrágicos (p. ej., hipoprotrombinemia) por un mecanismo competitivo con la vitamina K, los que responden bien a la administración de dicha vitamina.
Por su importancia y aplicabilidad vale la pena revisar someramente el mecanismo de acitivación de la vitamina K sobre los factores de la coagulación sensibles a la misma y aclarar de esta manera algunos aspectos relativo a su uso y como intervienen las altas dosis y tratamientos prolongados con aspirina en el proceso de gammacarboxilación.
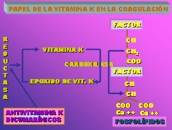

Esquema 7
Los factores de la coagulación II, VII, IX y X y proteína C y S forman las llamadas proteínas vitamina K dependientes con actividad coagulante o inhibidora.
Otras proteínas K dependientes que no inciden en la coagulación son la Osteocalcina, Aterocalcina y Proteínas M y Z.
Las proteínas K dependientes se sintetizan en el hígado a nivel postribosomal, una carboxilasa dependiente de vitamina K introduce un grupo carboxilo en la posición gamma de los residuos del ácido glutámico. Esta gammacarboxilación le confiere a la molécula una densidad de cargas fuertemente negativa, por eso el Ca ++ actúa de puente y el factor se une a la superficie fosfolipídica, también cargada negativamente. Así se concentran sustratos y enzimas sobre una misma matriz sólida y las reacciones ocurren con mucha mayor eficiencia que en la fase fluida.
La introducción del carboxilo en posición gamma del ácido graso es mediante oxidación de la vitamina K a su derivado epóxido; este por una reductasa regenera a vitamina K reducida que es la forma activa para su empleo ulterior.
Esta reacción puede ser interferida por la acción de drogas antivitamina K como son los anticoagulantes orales como el acenocumarol, la warfarina que inhiben a la reductasa y disminuyen la cantidad de vitamina K disponible. Se liberan a la circulación factores normales pero carecen de grupos gamma carboxiglutámicos y tienen por ello menor capacidad para activar el mecanismo de la coagulación. Se les denomina genéricamente siguiendo a Hemker PIVKA (proteína inducida por vitamina K ausente) (Esquema 7).
Cuando se suspende la medicación anticoagulante estos factores vuelven a carboxilarse recuperando su actividad biológica. (22)


Tabla 1
Conclusiones
Las plaquetas lideran cada uno de los acontecimientos de la hemostasia natural según podemos apreciar en el cuadro resumen, de manera que aunque la aspirina tiene un indiscutible valor clínico en la prevención de la trombosis coronaria y cerebral puede también entorpecer la hemostasia natural en un sujeto que experimente una lesión tisular sangrante en cualquier región de la economía, promoviendo así mayor pérdida de sangre y dando un tiempo de sangramiento anormal.
Continuamente existe un juego reciproco entre PG-I2 y TxA2, cuando la sangre fluye normalmente por los vasos sanguíneos predomina el primero, sin embargo ante una lesión tisular se pronuncian los factores protrombóticos destacando entre ellos el TxA2, el cual promueve como hemos comentados vasoconstricción y propicia la agregación plaquetaria, de aquí la utilidad clínica de la aspirina previniendo las trombosis.
Los Coxibs son un nuevo tipo de fármacos antiinflamatorios capaces de inhibir selectivamente COX-2, sin inhibir COX-1 en todo su espectro terapéutico. Sin embargo, vienen apareciendo reportes cada vez más frecuentes por diversos autores donde proponen que la disminución de PGI2 con capacidad antiagregante y vasodilatadora secundaria a la inhibición de COX-2, sin inhibir el TXA2 (agente plaquetario), puede afectar el equilibrio entre prostaglandinas protrombóticas y antitrombóticas, aumentando la actividad protrombótica; la conclusión a priori sería que el uso de Coxibs puede aumentar el riesgo cardiovascular, aunque esta hipótesis fisiopatológica precisa ser demostrada. Es evidente que los Coxibs constituyen un medio terapéutico indiscutible que no debe ser devaluado sin una comprobación científica contundente (Tabla 1).
Bibliografía
1) Bick RL, Murano G: Physiology of hemostasis. Clin Lab Med 24:677, 1994
2) Ww KK, Thiagarajan P: Role of endothelium in thrombosis and hemostasis. Ann Rev Med 47:315, 1966
3) Lijnen HR, Collen D: Endothelium in hemostasis and thrombosis. Prog Cardiovasc Dis 39:343, 1997
4) Packham MA: Roles of platelets in thrombosis and hemostasis. Can J Physiol Pharmacol 72:278, 1994
5) Cruz MA, et al: Interaction of the von Willebrand factor (vWF) with collagen: localization of the primary collagen-binding site by analysis of recombinant vWF a domain polypeptides. J Biol Chem 270:10822, 1995
6) Harker LA, et al: Antithrombotic strategies targeting thrombin activities, thrombin receptors, and thrombin generation. Thromb Haemostas 78:736, 1997
7) Lijnen HR, Collen D: Mechanisms of physiological fibrinólisis. Baillieres Clin Haematol 8:277, 1995
8) Tans G, et al: Regulation of thrombin formation by activated protein C: effect of the factor V Leiden mutation. Semin Hematol 34:244, 1997
9) Goodman and Gilman: Las Bases Farmacológicas de la terapéutica. Novena edición, vol. I, 2000, pag. 661
10) Caen JP, Rosa JP: Platelet-vessel wall interaction: from bedside to molecules .Thromb Haemost 74: 18, 1995
11) Hoffman M, et al: Cellular interactions in hemostasis. Haemostasis 26 (suppl 1): 12, 1996
12) Von der Weid NX, Mansouri Taleghani B, Wuillemin WA: Severe nose bleeding after intake of acetylsalicylic acid: von Willebrand disease. Pediatric Haematology and 0ncology Unit, University Hospital, Bern, Switzerland. Hamostaseologie. 2003 aug, 23 (39: 135-7
13) Willoughby S, Pearson TC: The use of aspirin in polycythaemia vera and primary trombocythaemia. Department of Haematology, St Thomas Hospital, London, UK. Blood Rev. 1998 mar; 12 (1): 12-22
14) Landolfi R, Patrono C: Aspirin in polycythemia vera and essential thrombocythemia: current facts and perspectives. Department of Internal Medicine, Catholic University School of Medicine, Rome, Italy. Leuh Lymphoma. 1996 sep; 22 Suppl 1:83-6
15) Livesey JR, Watson MG, Kelly PJ, Kesteven PJ: Do patients with epistaxis have drug induced platelet dysfunction? Department of 0tolaryngology, Freeman Hospital, Newcastle-irpon-tyne, UK. Clin 0tolaryngol. 1995 0ct, 20 (5) : 407-10
16) Kim HL, Kovacs MJ: Diclofenac-associated thrombocytopenia and neutropenia. University of Western 0ntario, London, Canada. Ann Pharmacother. 1995 jul-aug; 29 (7-8): 713-5
17) Mukherjee D. Nissen SE. Topol E: Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 288: 954-959
18) Piqué JM. ¿Por fin antiinflamatorios menos gastrolesivos? Gastroenterolllepatol 2000; 23: 87-9
19) Lanas A. Estrategia clínica para el paciente que precisa antiinflamatorios no esteroides: posición de los inhibidores de la COX-2. Gastroenterolllepatol 2001; 24: 22-36
20) Baud p, Tobler A, Lammle B, Alberio L: Acquire von Willebrand syndrome in a myeloproliferative disorder. Central Haematology Laboratory, Inselspital, University Hospital, 3010 Bern, Switzerland. Haemostaseologie. 2003 aug; 23 (3): 121-4
21) RAPT Investigators. Randomized trial of ridogrel, a combined thromboxane A2 synthase inhibitor and thromboxane A2/prostaglandin endoperoxide receptor antagonist, versus aspirin as adjunct to thrombolysis in patients with acute myocardial infarction. Circulation. 1994, 89: 588-595
22) Middleton C: Non-steroidal anti-inflammatory drugs: indications for use. Nervill Hall Hospital, Guent Healtheare NHS Trust. Nurs times. 2003 apr 22-28; 99 (16): 30-2


