|
TRABAJOS ORIGINALES
Dra. Cecilia Coto Hermosilla*, Dra. Melba Méndez Méndez**,Lic. Idrian García García***, Elizabeth García Iglesias****, Dr. Pedro Lopez Saura*****
* Especialista de 1er grado en Pediatría y 2do grado en Reumatología. Profesora Auxiliar de Pediatría de la Facultad “Manuel Fajardo”. Especialista de Reumatología Pediátrica de los Hospitales “Pedro Borrás” y “Juan Manuel Márquez”.
** Dra. en Medicina. Especialista de 1er grado en Pediatría. Hospitales “Pedro Borrás” y “Juan Manuel Márquez”.
*** Licenciado en Ciencias Farmacéuticas. Master en Farmacología. Monitor.CIGB.
**** Licenciada en Matemáticas. CIGB
***** Doctor en Medicina. Doctor en Ciencias Biológicas. Especialista de 2do grado en Bioquímica. Investigador Titular. Director de Regulaciones y Ensayos Clínicos, CIGB. Asesor.
RESUMEN
La esclerodermia se caracteriza por la presencia de fibrosis en múltiples órganos y sistemas, afectando fundamentalmente la piel, tubo digestivo, pulmones, corazón y riñones. La afectación básica es un trastorno de la microcirculación y del tejido conectivo, lo que conlleva lentamente a obliteración vascular y fibrosis secundaria en los órganos diana. Su tratamiento es difícil. Las terapias se dirigen a mejorar la circulación periférica y a disminuir la fibrosis con diversas terapéuticas entre las que se encuentra el Interferón gamma recombinante. Se utilizó el INF γ R en 15 pacientes pediátricos, 13 niñas y 2 niños, 10 Blancos y 5 mestizos. La edad fue de 8 ± 4 años al momento de iniciar tratamiento. Los tipos de esclerodermia: 14 localizadas, (7 morfeas y 7 lineales) y una ESP. Con tratamientos anteriores: 9 con D-penicilamina, 7 con Vit E. La evaluación de los score de Rodnan modificado demostró una disminución de los mismos en 66.7% de los pacientes y estabilización en otros 3. Existió una disminución promedio de 1 y 3 puntos, en los score 1 y 2, respectivamente. En ambos casos las disminuciones (final vs inicio) fueron estadísticamente significativas (P<0.05). En total el 80% mejoró o estabilizó el estado de la enfermedad, lo cual en gran medida se corresponde con lo obtenido en estudios previos. El IFN g fue bien tolerado. Estos resultados sugieren que el IFN g (Heberon Gamma R®), producto cubano, puede tener un efecto beneficioso en el tratamiento de la esclerodermia, al menos en su forma localizada.
INTRODUCCIÓN
La esclerodermia es una enfermedad del tejido conectivo que se caracteriza por la presencia de fibrosis en múltiples órganos y sistemas, afectando fundamentalmente la piel, tubo digestivo, pulmones, corazón y riñones.
La afectación básica de la enfermedad es un trastorno de la microcirculación (capilares y arterias de pequeño calibre) y del tejido conectivo, lo que conlleva lentamente a obliteración vascular y fibrosis secundaria en los órganos diana.
Algunos pacientes sólo muestran alteraciones localizadas a nivel de la piel, mientras que otros, además presentan afectación de órganos internos, denominándose entonces la enfermedad, esclerosis sistémica. Existe la llamada ‘‘esclerodermia sine esclerodermia’’, la cual se caracteriza por la presencia de fibrosis en los órganos internos sin afectación de la piel.
La enfermedad puede manifestarse en diferentes grados de severidad y progresión, observándose pacientes con sólo simples lesiones cutáneas y otros con grandes afectaciones viscerales, de los cuales algunos evolucionan rápidamente hacia las complicaciones renales, pulmonares y cardiacas, capaces de provocar la muerte. [1-7].
La Esclerodermia se divide en las formas localizada y sistémica. La forma localizada se divide en: Morfea, Escleroderma lineal y Golpe de sable. Por su parte, la Esclerosis Sistémica se divide en difusa y limitada mayormente, en dependencia de la extensión de las complicaciones cutáneas y el patrón acompañante de afectaciones en órganos internos [5,6].
El tratamiento de la Esclerodermia es difícil y sigue siendo un gran reto para los clínicos. Debido a que la causa se desconoce, las terapias se dirigen a mejorar la circulación periférica con el uso de vasodilatadores (bloqueadores de canales de calcio [nifedipina], inhibidores de la enzima convertidora de angiotensina y prostaglandinas [epoprostenol]), a prevenir la síntesis y liberación de citoquinas dañinas con inmunosupresores (metotrexate, ciclosporina, ciclofosfamida, fotoféresis extracorpórea), e inhibir o reducir la fibrosis con agentes que reducen la síntesis de colágeno o refuerzan la producción de colagenasa (D-penicilamina, colchicina, interferón gamma, y relaxina). Otros tratamientos incluyen corticoesteroides, análogos de vitamina D (calcitriol), UV-A, y vitamina E. Los reportes preliminares de nuevas terapias incluyen el uso de minociclina, el trasplante pulmonar, el transplante autólogo con células madre, etanercept y talidomida [7-13].
De los estudios con IFN gamma, en el primero de ellos el producto se asoció con efectos beneficiosos sobre las complicaciones cutáneas de 18 pacientes adultos con Esclerosis Sistémica rápidamente progresiva. El espesor medio de la piel decreció de 25.9 a 19.1 (P < 0.03). Los score medios disminuyeron de 33.1a 19.6 (P < 0.02) después de 18 semanas de tratamiento. Diez pacientes los redujeron >25% y otros cinco ³ 70% [14]. Otros 14 pacientes adultos con Esclerosis Sistémica fueron tratados con IFN gamma, 9 de ellos hasta 1 año. Se observó mejoría significativa en el score total de piel, y en la PaO2, aunque no se alteraron otros parámetros clínicos. No se presentaron eventos adversos serios [15].
Otros autores encontraron beneficios considerados modestos en 20 pacientes adultos con Esclerosis Sistémica. Nueve pacientes tuvieron > 20% de reducción del score cutáneo, uno de ellos con remisión completa. Sin embargo, 8 pacientes no cambiaron apreciablemente durante el ensayo, y 10 pacientes salieron del mismo por complicaciones asociadas a la enfermedad [16]. En un estudio controlado, multicéntrico se concluyó que el IFN gamma produjo efectos beneficiosos ligeros sobre la esclerosis cutánea y la sistémica, con aceptable tolerabilidad. Los score medios tendieron a mejorar en el grupo IFN (P > 0.05). La apertura de la boca se incrementó significativamente de 38.5 a 47.7 en dicho grupo (P < 0.001). La mejoría en síntomas y órganos complicados también fue más evidente en el grupo IFN. Sin embargo, los parámetros de calidad de vida mejoraron más en el grupo control [17).
Los agentes antifibróticos, no parecen eficaces en el tratamiento de la esclerosis sistémica. La penicilamina es la droga más antigua de este grupo. Si bien es un fuerte inhibidor de los entrecruzamientos de colágeno, su eficacia es dudosa. El Interferón gamma disminuye la producción de colágeno e interfiere con la proliferación de fibroblastos al reducir la expresión de TGF-beta. Sin embargo, los estudios al respecto no mostraron que sea muy eficaz. (18)
Dycot M y col (8) describen la primera serie de casos tratados con imiquimod 5% en crema, es un inductor del INF gamma, conocido por inhibir el TGF beta, uno de los responsables de la fibrosis, con resultados exitosos en el tratamiento de la morfea de 12 pacientes con disminución de la induración.
El-Mofty M, (9) en un estudio sobre la acción de la radiaciones ultravioletas en la piel de pacientes con morfea , concluye que la eficacia de baja dosis de fototerapia UVA en el tratamiento de la esclerodermia localizada puede ser debido al incremento de INF gamma lo que produciría una disminución de TGF beta y de la producción del colágeno.
Obermoster y col. (19) consideraron satisfactoria la respuesta de un paciente con esclerodermia lineal (en golpe de sable) con manifestaciones neurológicas y oftalmológicas. Este dato fue reportado en otro caso publicado con lesión en golpe de sable por Martínez y col. (20)
Por haber utilizado previamente en Artritis Idiopática Juvenil el INF gamma con efectos satisfactorios y con reacciones adversas de poca importancia (21), se decidió usar el Interferón gamma Recombinante, producto cubano del Centro de Ingeniería Genética Biotecnología (CIGB), en niños con esclerodermia basándonos en sus propiedades inmunomoduladoras y antifibróticas.
El Interferón Gamma es una citocina producida por las células T y las células NK, con efectos antiviral, antiproliferativo, inmunomodulador y antifibrótico. Los efectos anti-inflamatorios de esta citocina producida por las células TH1 y con características pro inflamatorias, aún no han sido bien dilucidados. Muhl y col demuestran que inhibe la producción de Il 1 e Il 8 e induce la producción de IL1-Ra e Il-18BP (22)
PRESENTACIÓN Y DISCUSIÓN DE CASOS
Dados los antecedentes de resultados satisfactorios con el empleo del IFN g en la Esclerodermia, el Servicio de Reumatología Pediátrica del Hospital “Pedro Borrás Astorga” solicitó al CIGB el IFN g necesario para el tratamiento compasional de un grupo de 15 pacientes diagnosticados con Esclerodermia afectados en su mayoría desde edades muy tempranas, que asistían regularmente a esa consulta. La mayoría había recibido tratamientos previos con D-penicilamina y/o Vitamina E, pero sin respuesta clínica, con signos y síntomas agravados.
La inexistencia en su momento y aún en la actualidad de tratamientos totalmente efectivos a mano, la gran mayoría paliativos, hizo necesario tal requerimiento, teniendo en cuenta además el grado de deterioro físico que estaban experimentando esos niños. Esperar mucho tiempo podría haber tenido consecuencias muy desfavorables para su desarrollo psicomotor futuro. Se requirió del consentimiento escrito de los padres o tutores, y el comprometimiento del investigador principal y de la institución.
Dichos pacientes debían encontrarse en edad pediátrica (menores de 16 años), no podían presentar enfermedades sistémicas que imposibilitaran la evaluación o interfirieran con el tratamiento, ni embarazo. Se administró el IFN ganma por vía intramuscular en la región glútea, bajo el mismo esquema que había resultado exitoso en una enfermedad similar como la Artritis Reumatoide Juvenil. El tratamiento tuvo una duración máxima de 2 años. Las primeras 4 semanas se administraron 50 000 UI/Kg/día, hasta un máximo de 1 000 000 UI (2 bulbos de IFN ) diarios, los siguientes 3 meses igual dosis 3 veces por semana, y luego también la misma dosis hasta completar 2 años.
Los datos de los 15 pacientes tratados con IFN g se reflejan en la Tabla 1. Para evaluar el estado de las lesiones se utilizaron las 2 escalas de puntos (score) cutáneos modificados de Rodnan [23-29], métodos clásicos para evaluar el estado de la enfermedad en el adulto, que involucra la división por sitios o partes del cuerpo y la categorización en grados, y pueden ser utilizados ambos o no en dependencia de la forma de presentación de la enfermedad. A mayor puntuación o score, las lesiones son más extensas y severas. En niños no hay métodos validados para evaluar la evolución de la esclerodermia. La respuesta al tratamiento se evaluó de la siguiente forma:
Mejoría: reducción en al menos 1 punto en cualquiera de los score.
Estable: Igual puntaje.
No respuesta: aumento en al menos 1 punto en cualquiera de los score.
También para evaluar la respuesta, aunque en menor medida, se tuvieron en cuenta la necesidad de otros tratamientos para controlar la enfermedad, y la tolerancia al IFN gamma .
Dichos pacientes debían encontrarse en edad pediátrica (menores de 16 años), no podían presentar enfermedades sistémicas que imposibilitaran la evaluación o interfirieran con el tratamiento, ni embarazo. Se administró el IFN gamma por vía intramuscular en la región glútea, bajo el mismo esquema que había resultado exitoso en una enfermedad similar como la Artritis Reumatoide Juvenil. El tratamiento tuvo una duración máxima de 2 años. Las primeras 4 semanas se administraron 50 000 UI/Kg/día, hasta un máximo de 1 000 000 UI (2 bulbos de IFN ) diarios, los siguientes 3 meses igual dosis 3 veces por semana, y luego también la misma dosis hasta completar 2 años.
Los datos de los 15 pacientes tratados con IFN gamma se reflejan en la Tabla 1. Para evaluar el estado de las lesiones se utilizaron las 2 escalas de puntos (score) cutáneos modificados de Rodnan [23-29], métodos clásicos para evaluar el estado de la enfermedad en el adulto, que involucra la división por sitios o partes del cuerpo y la categorización en grados, y pueden ser utilizados ambos o no en dependencia de la forma de presentación de la enfermedad. A mayor puntuación o score, las lesiones son más extensas y severas. En niños no hay métodos validados para evaluar la evolución de la esclerodermia. La respuesta al tratamiento se evaluó de la siguiente forma:
Mejoría: Reducción en al menos 1 punto en cualquiera de los score.
Estable: Igual puntaje.
No respuesta: Aumento en al menos 1 punto en cualquiera de los score.
También para evaluar la respuesta, aunque en menor medida, se tuvieron en cuenta la necesidad de otros tratamientos para controlar la enfermedad, y la tolerancia al IFN gamma.
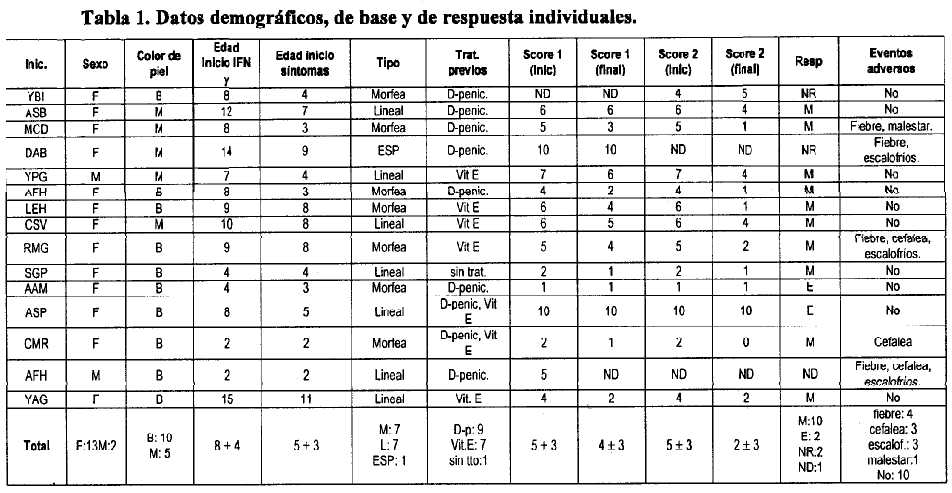 
Leyenda: F: Femenino; M: Masculino; B: Blanca; M: Mestiza; ESP: Esclerosis Sistémica Progresiva; D-penic: D-penicilamina; Vit E: Vitamina E; M: Mejorado; NR: No respuesta; E: Estable; ND: dato no disponible. Las edades se expresan en años, media (+ -) DS. Score 1: media (+ -) DS; Score 2: mediana (+ -) RQ.
Como se observa, predominaron las niñas de piel blanca, y todos los pacientes excepto uno presentaban la forma localizada de la enfermedad. La mediana de la edad fue de 8 años al momento de iniciar tratamiento, con 3 años padeciendo la enfermedad. Solo un paciente no había recibido tratamiento previo, pero su diagnóstico era reciente. La evaluación de los score de severidad demostró una disminución de los mismos en 10 de los 15 pacientes (66.7%) y estabilización en otros 3, al final del tratamiento. Otro paciente incrementó un score y el otro no pudo ser evaluado.
Existió una disminución promedio de 1 y 3 puntos, en los score 1 y 2, respectivamente. En ambos casos las disminuciones (final vs inicio) fueron estadísticamente significativas (P menor de 0.05). Siete pacientes redujeron al menos uno de los score 50% ó más, 4 de ellos lo hicieron con ambos score. El paciente que incrementó uno de los score lo hizo solo un 20%. En total el 80% mejoró o estabilizó el estado de la enfermedad, lo cual en gran medida se corresponde con lo obtenido en estudios previos (ver Introducción). Esta enfermedad es progresiva, con crisis frecuentes, por lo que la sola estabilización significa un buen resultado. Sin embargo, la niña con Esclerosis Sistémica Progresiva, la forma más agresiva de la enfermedad fue no respondedora.
El IFN ganma fue bien tolerado, solo un tercio de los pacientes presentó al menos un evento adverso, predominando la fiebre (4), la cefalea (3) y los escalofríos (3), el otro evento presentado fue malestar general. Estas reacciones por lo general fueron de intensidad leve, excepto un paciente que tuvo que discontinuar el tratamiento a los 8 meses debido a reacciones serias, aunque también tuvo progresión de las lesiones.
En la próxima tabla se ofrece la información sobre el cumplimiento del tratamiento con , y la posterior evolución de los pacientes concluido el mismo.
Como se observa, el cumplimiento del tratamiento puede ser catalogado como bueno, 12/15 . En dos casos la(80%) pacientes cumplieron los 2 años de tratamiento con IFN discontinuación del tratamiento se debió a progresión de la enfermedad y en otro por reacciones adversas serias y no respuesta, este último no pudo tener evaluación final. Durante el tratamiento solo en 2 pacientes fue necesaria la incorporación de otros tratamientos como esteroides, D-penicilamina, colchicina, etc. Siempre que lo requirieran, algunos pacientes pudieron continuar el tratamiento a dosis de mantenimiento.
Por lo que encontramos hay criterios contradictorios sobre el uso de Interferón gamma en la esclerodermia (14-18) No hay estudios previos en pacientes pediátricos con INF gamma, exceptuando el niño con lesión de golpe de sable publicado por Obermoser (19). Es interesante comprobar que es una entidad rara en la infancia y que las publicaciones son anecdóticas por lo que quedan pendientes estudios de cohortes mayores para saber realmente como se comporta la evolución de la enfermedad en la infancia . Se han realizado 2 series de más de 100 pacientes con Esclerosis Sistémica Juvenil que prometen dar resultados alentadores sobre el conocimiento de la entidad en la infancia (29,30). Actualmente se cuenta con los Criterios Preliminares de la Esclerosis Sistémica Juvenil (31), quedan pendiente criterios de evaluacion de la actividad y daño de la enfermedad para poder tener más uniformidad en el uso de la valoracion de los pacientes con tratamientos diversos.

El seguimiento post-tratamiento de los 12 casos con INF gamma cumplidores hasta varios años después, demuestra una evolución positiva, con mejoría sostenida en varios casos. En un paciente las lesiones desaparecieron. Solo en uno aparecieron nuevas lesiones. Estos (Heberon Gamma R®) puede tener un efectoresultados sugieren que el IFN beneficioso en el tratamiento de la Esclerodermia, al menos en su forma localizada. La realización de estudios clínicos controlados en poblaciones mayores serían necesarios para confirmar estos resultados.
REFERENCIAS BIBLIOGRÁFICAS
1. LeRoy EC, Black CM, Fleischmajer R, et al. Scleroderma (systemic sclerosis): Classification, subsets and pathogenesis. J Rheumatol 1988; 15:202.
2. LeRoy EC. Pathogenesis of Systemic Sclerosis (Scleroderma). Chapter 76, p1481-1490. In Koopman: Arthritis and Allied Conditions, 13th ed., Copyright © 1997 Williams & Wilkins.
3. Athreya BH.Juvenile scleroderma.Curr Opin Rheumatol 2002 Sep;14(5):553-61.
4. Bottoni CR, Reinker KA, Gardner RD, Person DA.Scleroderma in childhood: a 35-year history of cases and review of the literature. J Pediatr Orthop 2000 Jul-Aug;20(4):442-9.
5. Cassidy JT. Lupus Eritematoso sistémico, dermatomiositis juvenil, esclerodermia y vasculitis en: Kelly’s: Tratado de Reumatología. 6ta edición Madrid: Marbán Libros: 2003; 3:1323-1327
6. Chozas NC, García SP Esclerodermia en la infancia en: Reumatología Infantil Ed Formación Alcalá: Formación Continuada de Pediatría: 2004, Vol 8;11:261-272.
7. Sapadin AN, Fleischmajer R. Treatment of scleroderma. Arch Dermatol 2002; 138(1):99-105.
8. Dytoc M,Ting PT, Man J, Sawywe D, Fiorillo L. First case series on the use of uniquimod for morphoea. Br J Dermatol. 2005 Oct;153(4):815-20
9. El-Mofty M, Mostafa W, Esmat S, Yopussef R, Bousseila M, et al. Suggested mechanisms of action of UVA phototherapy in morphea: a molecular study Photodermatol Photoimmunol Photomed. 2004 Apr;20(2):93-100.
10. Foeldvari I, Wulffraat N.Recognition and management of scleroderma in children. PaediatrDrugs2001;3(8):575-83
11. Rosenkranz M, Agle L, Efthimiou P, Lehman T. Systemic and localized Scleroderma in Children:Curren and Future Treatment Options Pediatric Drugs 8(2):85-97,2006.
12. Martini A.Juvenile systemic scleroderma. Curr Rheumatol Rep 2001 Oct;3(5):387-90
13. Nagai Y, Hattori T, Ishikawa O.Unilateral generalized morphea in childhood.J Dermatol 2002 Jul;29(7):435-8.
14. Freundlich B, Jimenez SA, Steen VD, Medsger TA Jr, Szkolnicki M, Jaffe HS. Treatment of systemic sclerosis with recombinant interferon-gamma. A phase I/II clinical trial. Arthritis Rheum 1992; 35(10):1134-42.
15. Hein R, Behr J, Hundgen M, Hunzelmann N, et al. Treatment of systemic sclerosis with gamma-interferon. Br J Dermatol 1992; 126(5):496-501.
16. Polisson RP, Gilkeson GS, Pyun EH, Pisetsky DS, Smith EA, Simon LS. A multicenter trial of recombinant human interferon gamma in patients with systemic sclerosis: effects on cutaneous fibrosis and interleukin 2 receptor levels. J Rheumatol 1996; 23(4):654-8.
17. Grassegger A, Schuler G, Hessenberger G, et al. Interferon-gamma in the treatment of systemic sclerosis: a randomized controlled multicentre trial. Br J Dermatol 1998; 139(4):639-48.
18. Hunzelmann N, Anders S, Fierlbeck G et al. Double-blind,placebo-controlled study of intralesional interferon gamma for the treatment of localizad slceroderma. J Am Acad Dermatol 1997; 36:433.
19. Obermoser G, Pfausler BE, Linder DM, Sepp NT. Scleroderma en coup de sabre with central nervous system and ophthalmologic involvement: treatment of ocular symptoms witn interferon gamma. J Am Acad Dermatol. 2003 Sep;49(3):543-6
20. Martinez VE, Ramos-Garibay A. Estrada I. Esclerodermia en golpe de sable. Reporte de un caso. Rev Cent Dermatol Pascua Vol 14 No 1. Ene-Abril 2005
21. Coto C,Varela G., Hernández V, Mendez M. .Use of recombinant interferon gamma in pediatric pacients with Juvenil Reumatoide Artritis.Biotherapy 1998; 11:15-20.
22. Muhl H, Pfeilschifter J. Anti-inflammatory properties of pro-inflammatory interferon gamma. International Inmunopharmacology (2003)1247-1255
23. Ramsden MF Goldsmith CH et al Clinical assessment of scleroderma: Observer variation in five methods (abstract B24). Arthritis and Rheumatism. 1986; 29 (supplement): S61.
24. Brennan P. Silman A et al. Reliability of skin involvement measures in scleroderma. Br. J. Rheumatol. 1992; 31: 457-460.
25. Pope JE Bellamy N. Outcome measurement in scleroderma clinical trials. Seminars Arthritis Rheumatism. 1993; 23: 22-33.
26. Clements P Lachenbruch P et al. Inter and intraobserver variability of total skin thickness score (modified Rodnan TSS) in systemic sclerosis. J Rheumatol 1995; 22: 1281-1285.
27. Pope JE Baron M et al. Variability of skin scores and clinical measurements in scleroderma. J Rheumatol 1995; 22: 1271-1276.
28. Silman A Harrison M Brennan P. Is it possible to reduce observer variability in skin score assessment of scleroderma. J Rheumatol. 1995; 22: 1277-1280.
29. Martini G, Foeldvari I, Russo R, et al Systemic sclerosis in childhood: clinical and immunologic features of 153 patients in an international database. Arthritis Rheum. 2006;54:3971–3978.
30. Scalapino K, Arkachaisri T, Lucas M, et al. Childhood onset systemic sclerosis: classification, clinical and serologic features, and survival in comparison with adult onset disease. J Rheumatol 2006; 33:1004-1013.
31. Zulian F, Woo P, Athreya BH, Laxer RM, et al. The PRES/ACR/EULAR provisional classification criteria for juvenile systemic sclerosis. Study describing an international project aimed to define a provisional set of classification criteria for SSc in children on the basis of clinical data of real patients following a consensus-based methodology. Arthritis Rheum 2007; 57:203-212.
Recibido: 1ro de septiembre de 2008.
Aprobado: 20 de noviembre de 2008.
|


